�a���X���C�h�P�F�����̕\�݂Ɍ��ǐ������������F�߂�ꂽ�B
�a���X���C�h�Q�F�w���̃A���[�o���́B�i�Ԋۈ�j
�y�a�����������z
PCC1054
�����F�A���[�o�������Ƃ��Ȃ����咰���Ɛf�f���ꂽ�B
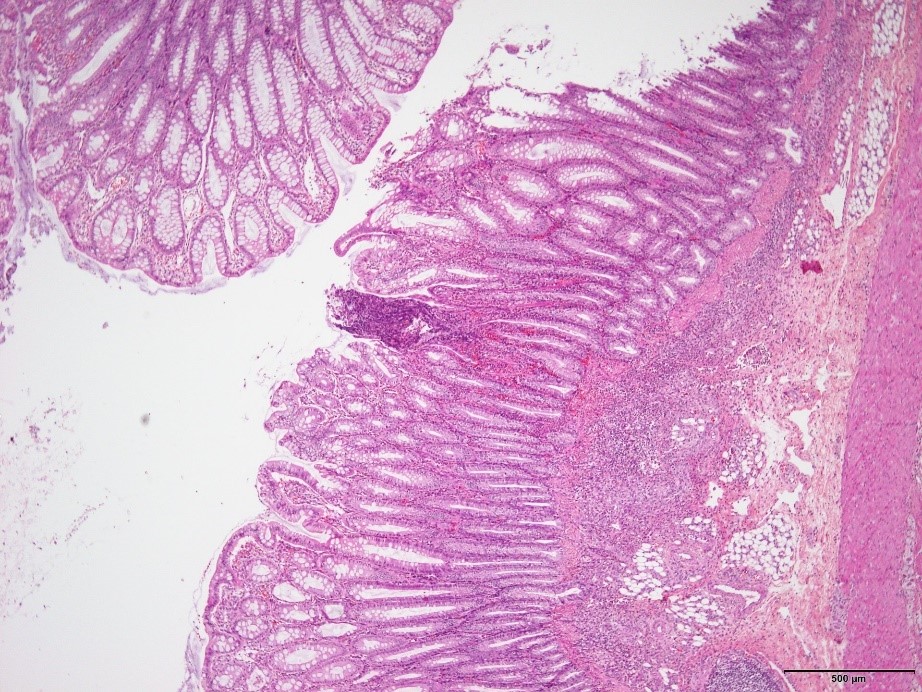
�E�����̍L�͈͂ɓn���āA�\�ݐ������������F�߂�ꂽ�B�i�a���X���C�h�R�j
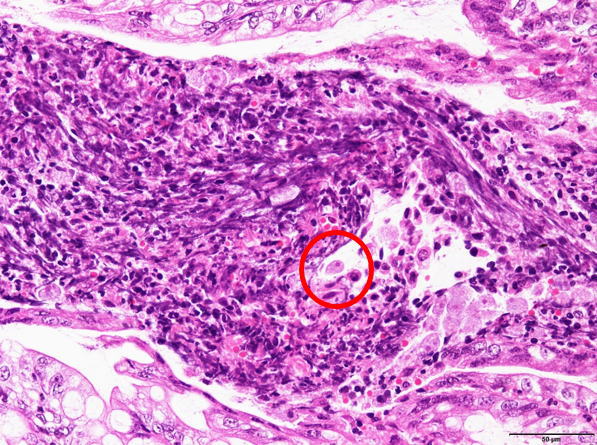
�E�w���̃A���[�o���́B�i�a���X���C�h�S�j
�E���̌��̂�PCR�����̌��ʂ���E.polecki�T�u�^�C�v3�����o���ꂽ�B
�a���X���C�h�R�F�����̍L�͈͂ɓn���āA�\�ݐ������������F�߂�ꂽ�B
�a���X���C�h�S�F�w���̃A���[�o���́B�i�Ԋۈ�j
�y���ʂƑ�z
�@����̌������ʂ��A�A���[�o�����ڑ咰�̔S������Q���A���lj��N�����o���y�щ������������ƍl������B�̃A���[�o�����ǂ̎��Õ��@�E���ʂɂ��Ă͂̕قƂ�ǂȂ��A�L����܂�1�ł��郁�g���j�_�]�[���̉ƒ{�ł̎g�p�͋֎~����Ă���B���_��ւ͊����g��h�~�̂��߁A���C�̗����ւ�����ŁA�؎ɐ��E���œ��̎��{�Ǘ���̃o�C�I�Z�L�����e�B���[���̌��������w�������B�Ȍ㔭�Ǔ����͌������A2018�N12�����ݓ��l�̏Ǐ�������͊m�F����Ă��Ȃ��B
�y�l�@�z
�@���Y���т��r����ƁA�A���[�o�����ǂ��^�������ǂ��������������ł͔_��FCR���������Ă������Ƃ����������B����āA�̃A���[�o�����ǂ͔_��FCR������������\������������邪�A�ǗႪ���Ȃ����߁A���̐ςݏd�˂��d�v�ł���ƍl������B
���֏Ǐ�������ɑ��A�ߋ��̏������Ƀ��[�\�j�A�����ǂ��^�������A�������w�I�����y�і�ܔ��������ے肳�ꂽ���Ƃ���A�Œ�ϔO�ɂƂ��ꂸ�A�ޏNJӕʂJ�ɍs���d�v���ɂ��Ċw�B�܂��A�������w�I�����ł͓���̕a���������̑��݂́g�L���h�݂̂�������ł����A�����Njy�̂��߂ɂ́A�a���g�D�w�I�����܂œ˂��l�߂Č��������{���邱�Ƃ̏d�v���ɂ��Ċw�B
�Q�D����@�R�z�q �搶 �F �����̕@���i�T�C�g���K���E�C���X�a�j�̏Ǘ�
�@�����̕@���i�T�C�g���K���E�C���X�a�j�́A�w���y�X�E�C���X2�ɂ���Ă����鎾�a�ł���A�S���E�̓������Ɋ������A�����͐��U�E�C���X��ێ���������B�Ǐ�͓̓���A�ڍs�R�̗̂L���A������Ȃǂɂ���ĈقȂ邪�A�ڍs�R�̉A���̐V���q����������ƁA������݁A�@�`�̗��o�A�ċz����Ȃǂ������A���S���邱�Ƃ����鎾�a�ł���B����A��ѐ��Y�̗{�؏�ɂāA�����̕@���Ɛf�f���ꂽ�Ǘ���o�������̂ł��̊T�v�����B
�y�ޗ��ƕ��@�z
�@�֓��n���ɏ��݂����200�����g�p�����ѐ��Y�̗{�؏�ɂ�����2018�N3���ɔ_���K�₵���ۂɁA���؎ɂɂ�����2�T��̚M���q�ŕ����ċz��������݂�P�Ȃǂ̌ċz��ǏF�߂�ꂽ�B�Ǐ��悵�Ă����q��1�����Ӓ�E���A���z��wPCC�ɂ�����a���g�D�w�I�����ɁA���̂����x�̂�SMC�i���j�ɂ�����a���T���ɋ������B
�y��U�����z
�@�E�x���t�̈ꕔ�Ŋ̕ω����F�߂�ꂽ�B
�@�S���̕\�ʂɏo�����F�߂�ꂽ�B
�y�a���̌����z
�@�x�̍ە��������ł͍ۂ͕������ꂸ�APCR�����ł́APRRS�E�C���X�A�}�C�R�v���Y�}�A�C���t���G���U�E�C���X�͉A���ł������B
�y�a�����������z
�@�x�̉��^���C�ǎx�x���A�S���̐S�؉A�̑��̂і������O�����A�t���̔^���t���A�t���̐��O�����A�݂̃����p�����݉��A�G���̝G��������є������ω��A���ǖ������p�̔������ω��ƃw���W�f���[�V�X����ѐ��O�����A�@�̕����̕@�����F�߂�ꂽ�B
PCC1070
�@�@�F�ؕ����̕@���i�T�C�g���K���E�C���X�a�j�Ɛf�f���ꂽ�B
�E�@�o�S���̔���y�єS�����̔����E�E���B�i�a���X���C�h�T�j
�E�S���ŗL�w�ɂ����郊���p���E�`���זE����̂Ƃ������ǍזE�̐Z���B�i�a���X���C�h�U�j
�E�@�B���̍זE�̋��剻�A�j�̋��剻�ƍD����j�������́B�i�a���X���C�h�V�j
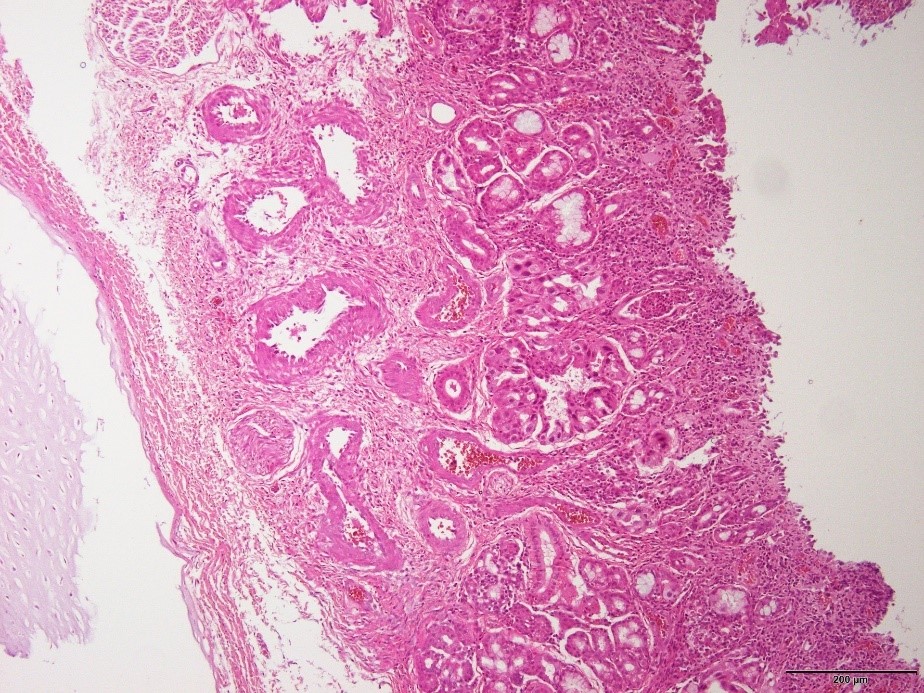
�a���X���C�h�T�F�@�o�S���̔���y�єS�����̔����E�E���B
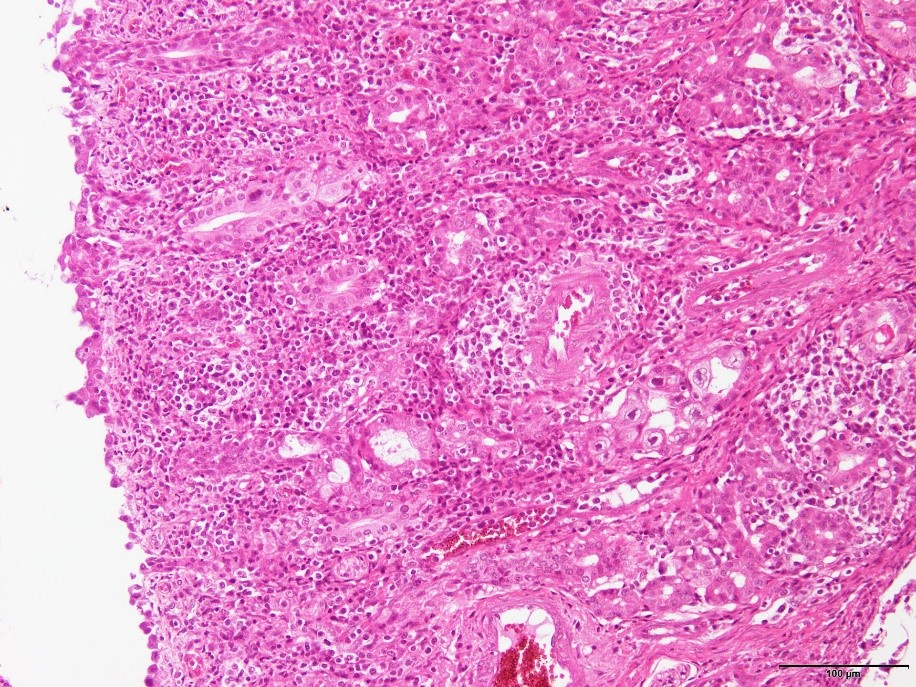
�a���X���C�h�U�F�S���ŗL�w�ɂ����郊���p���E�`���זE����̂Ƃ������ǍזE�̐Z��
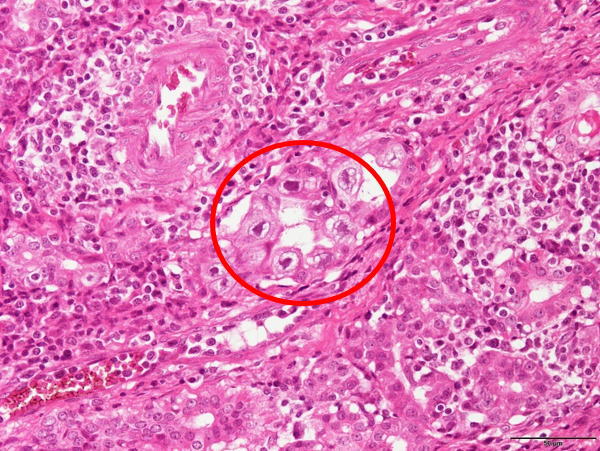
�a���X���C�h�V�F�@�B���̍זE�̋��剻�A�j�̋��剻�ƍD����j�������́B�i�Ԋۈ�j
�y���ʂƑ�z
�@�K�⎞�Ɋm�F�����Ƃ���A�S���ҕύX�ɔ������؎ɂ̊Ǘ����K�Ɉ����p����Ă��Ȃ��������Ƃ����������B�{�a�ɑ��鎡�Ö@��N�`���͂Ȃ��A�ڍs�R�̂̊l�����d�v�ł���Ƃ������Ƃ���A�V�S���҂ƕ��������̎��{���@���������A�q�ɏ������\���ɐێ悳����悤�Ɏw�������B���̌�A���݂܂łɕ��؎ɂŔx���Ǐ�͔F�߂��Ă��Ȃ��B
�y�l�@�z
�@�{�Ǘ�ł́A�@���̍ނ������Ƃ��f�f�ɂȂ������B�M���q�Ŕx���ǏF�߂�ꂽ�ۂ́A�x�����ł͂Ȃ��@�������č̍ނ���d�v�����w�B�܂��A���X�̊Ǘ��ɕω����������ꍇ�́A��{�I�ȊǗ������炽�߂Ċm�F���A���������Ƃ��d�v�ł���B
3�D�n���@�C�� �搶 �F PCV2d�����o���ꂽPCVAD
�@PCVAD�iPorcine Cirocovirus Associated Diseases�G�T�[�R�E�C���X�֘A���a�j�͓T�[�R�E�C���X2�^�iporcine circovirus2�FPCV2�j���֗^���鎾�a�ł���BPCVAD��1990�N��㔼��葼�̑����̍��Ŕ������m�F����A���E�̗{�؎Y�Ƃɐ[���ȑŌ���^���Ă���B���{�ł�1996�N���PCVAD�̔������m�F����Ă���BPCV2�̈�`�^�ɂ��ẮA���݂܂ł�PCV2a�APCV2b�APCV2c�APCV2d�y��PCV2e�̈�`�^������Ă���BPCV2a�͎��1997�`2003�N��PCVAD���a�Ȃ�тɌ��N���猟�o���ꂽ�E�C���X�ŁAPCV2�̃��N�`�����Ƃ��Ďg�p����Ă���BPCV2b��2004�N�ȍ~�̖k�Ă𒆐S�Ƃ���PCVAD�嗬�s���Ɏ�Ɍ��o���ꂽ�E�C���X�APCV2c��PCVAD���m�F�����O��1980�N��Ƀf���}�[�N���猟�o���ꂽ�E�C���X�ł���B�ߔN�́A�������͂��߂Ƃ��Ėk�āA�u���W���Ȃǐ��E�I��PCV2d���D����PCV2�Ƃ��Ċm�F����Ă���B�����PCV2d���F�߂�ꂽPCVAD�Ǘ�����B
�y�ޗ��ƕ��@�z
�@�֓��n���ɏ��݂����490�������炷���ѐ��Y�̗{�؏�ɂ����āA2018�N8���A85����̓،Q�ɂ����Ĕx���Ǐ�Ɣ���x�������������������B�����̓،Q���܂߂��_��S�̗̂Տ��ώ@���s���A85����̏d�x�푉��������2�����Ӓ�E���A���̂�����1���z��wPCC�ɂ�����a���g�D�w�I�����ɋ������B�܂��A7���ɔ_��S�̂̃��j�^�����O�������s�����Ƃ��ɍ̍ނ������t���̂�SMC�i���j�ɕa���T�����˗������B
�y��U�����z
�@�l�o�����p�߂̎��A�x�̈ꕔ�ōd�����F�߂�ꂽ�B
�y�a���̌����z
�@���t���̂�90����A120����A150����̓���̃v�[�����̂ŁAPCV2���z���ł���A��`�q��͂̌��ʂ���A�E�C���X����PCV2d�Ɣ��������B
�y�a�����������z
�@�x�ɉ��^���C�ǎx�Ԏ����x���A�S���ɐS�ؕϐ��A�G���ɂĝG�����A�����p�߂ɂē��������p�߉����F�߂��A����ɔx�ƃ����p�߂̖Ɖu���F�ɂ�PCV2���z���ƂȂ�APCV2�̊������m�肳�ꂽ�B
PCC1116
�x�F�Ԏ����x���Ɛf�f���ꂽ�B
�E�x�E���u�̔���y�єx�E�E�C�ǎx���ɍD�����Z���B�i�a���X���C�h�W�j
�E�Ɖu���F�ɂĊԎ��ɐZ�����Ă���}�N���t�@�[�W�Ɉ�v����PCV2�R���z�������F�߂���B�i�a���X���C�h�X�j
�E�}�N���t�@�[�W���̍D����זE���������́B�i�a���X���C�h�P�O�j
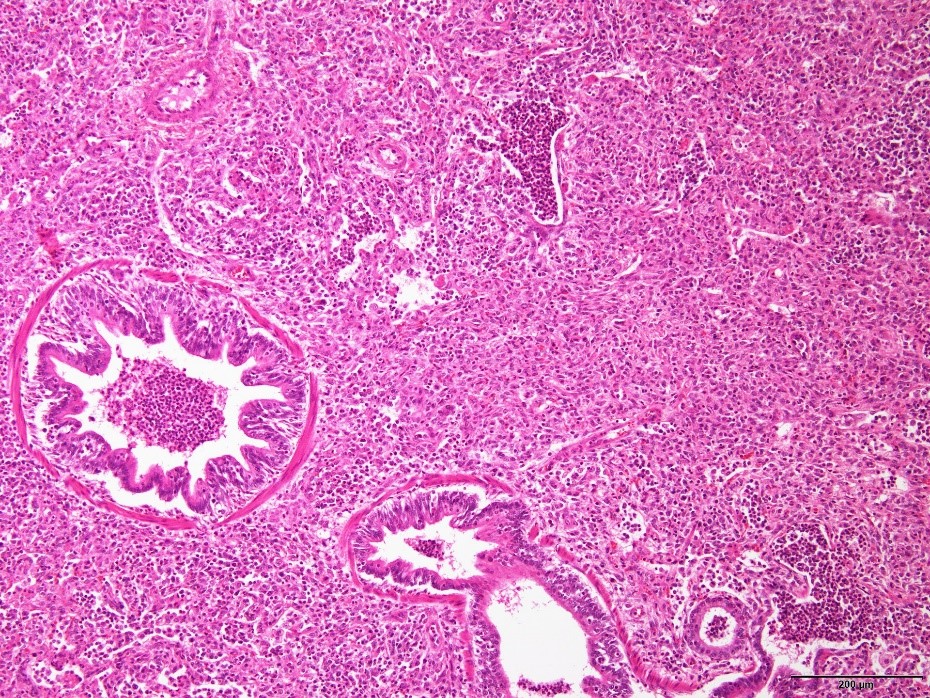
�a���X���C�h�W�F�x�E���u�̔���y�эC�ǎx���ɍD�����Z��
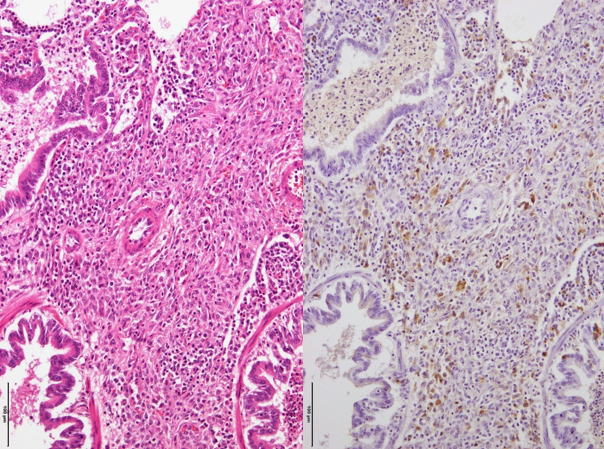
�a���X���C�h�X�F�Ɖu���F�ɂĊԎ��ɐZ�����Ă���}�N���t�@�[�W�Ɉ�v����PCV2�R���z�������F�߂���B�i���FHE���F�A�E�F�Ɖu���F�j
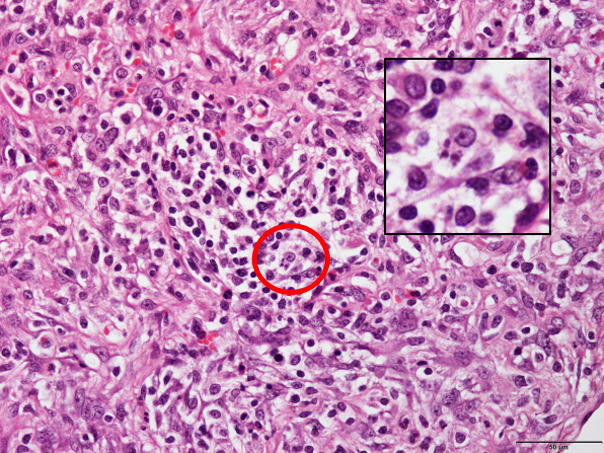
�a���X���C�h�P�O�F�}�N���t�@�[�W���̍D����זE���������́B�i�Ԋۈ�j
�l�o�����p�߁F���������p�߉��Ɛf�f���ꂽ�B
�E�}�N���t�@�[�W�̍��x�ȐZ���������p�߉��B�i�a���X���C�h�P�P�j
�E�Ɖu���F�ɂ�PCV2�R���z�����B�i�a���X���C�h�P�Q�j
�E���j���זE�̔����y�у}�N���t�@�[�W���̍D����זE���������́B�i�a���X���C�h�P�R�j
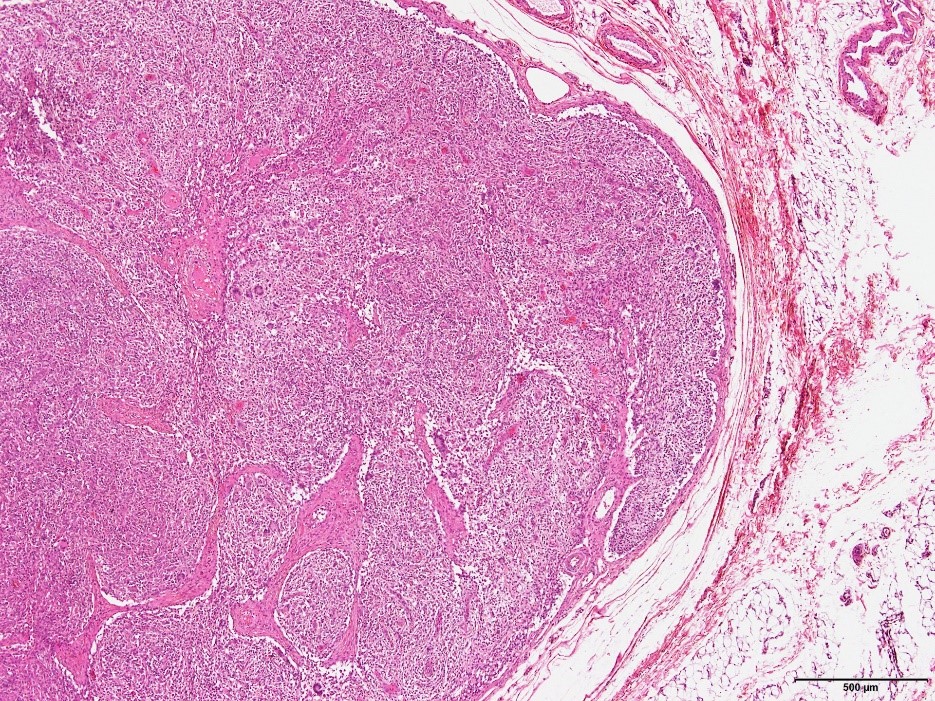
�a���X���C�h�P�P�F�}�N���t�@�[�W�̍��x�ȐZ���������p�߉��B
�a���X���C�h�P�Q�F�Ɖu���F�ɂ�PCV2�R���z�������F�߂���B�i���FHE���F�A�E�F�Ɖu���F�j
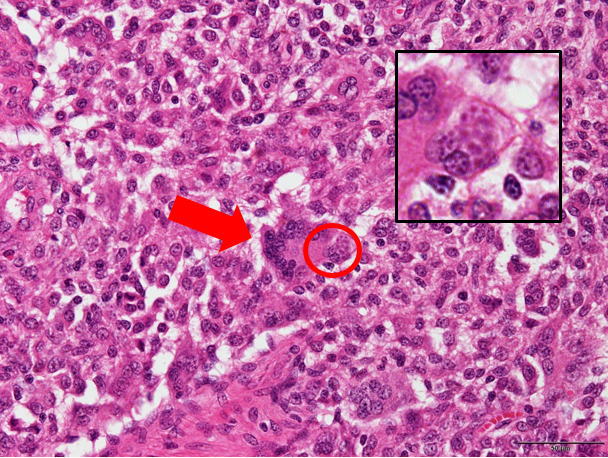
�a���X���C�h�P�R�F���j���זE�̔����i�Ԗ��j�y�у}�N���t�@�[�W���̍D����זE���������́B�i�Ԋہj
�y���ʂƑ�z
�@�Տ��Ǐ�y�ѕa���g�D�w�I�����A��`�q�����̌��ʂɂ��A����x���̌�����PCV2d�ɂ��PMWS�i�����㑽���퐫����s�Ǐnj�Q�j�Ɛf�f�����B
�@����������85����̓،Q�Ō����Ă���PCVAD���A�����ɂł����Ǐ����n�߂����߁APCV2�̃��N�`���ڎ펞����55�����25����ɑ��߂��B���̌��ʁA�S�̂�PCVAD�͎����Ɍ������Ă��Ă���B
�y�l�@�z
�@���PCV2���N�`���ڎ�ɂ��A�����̈ڍs�R�̂̊������O���āA����PCV2���N�`���ڎ��55����ōs���Ă������A���N�`���ڎ펞�����x�������\�����l����ꂽ�B
�@�܂��A�a���g�D�w�I�f�f�ƕa���T���̌��ʁAPCV2d�̊��������邱�Ƃ����炩�ɂȂ�A����s�����ƂŗՏ��Ǐ��P���ꂽ�B�����PCVAD�̓����𒍎����Ă��������B
4�D���@���� �搶 �F
����s�Ǔł̉��^���x���̎���Ƃ��̔����@���E�v���̌���
�@PMWS�iPCVAD�j���^�����ɒ[�Ȕ���s�ǂƌċz��Ǐ��悵��A�_��̗����Ɍ���̓�2����B�_��̔��ɑO���̓�3���A���v5���̂�a����U���APCC�y�і��Ԍ����@�ւŌ����������ʂ��ATrueperella pyogenes�iTp�j�ɂ�鉻�^���x���Ɛf�f�����B�قȂ�_��ŗގ��̏Ǐ�Ɛf�f���ʂ��̂ŁA���̔����@����v���������������B
�y�ޗ��ƕ��@�z
�@A�_��͕��1800���K�͂̔_��ł���A�̊O����������؍s���Ă��Ȃ��BB�_��͕��1400���K�͂̔_��ł���A�̊O��������GP�펓���؋y�ю~�ߗY�̂ݍs���Ă���B�ǂ���̔_���PS�펓���͎��Ɛ��Y���X�V����50���ȏ�ŁA�����E�����ƂɃI�[���C���E�I�[���A�E�g��������{���Ă���A�ɐB�_��ł�PRRS�A���ł���B
�@A�_���2018�N6�����{�̒���_��K�⎞�ɁA�����ɂŔ���s�ǁA�ߎ��悵��2���i63����j���AB�_��ł͓��N11�����{�̒���_��K�⎞�ɁA���ɂŔ���s�ǁA�ċz�����A���M��悵��3���i84����1���A112����2���j�����y�������ĕa����U���APCC��PCR�����ƕa���g�D�������˗����A���Ԍ����@�ւɂ͍ی�����PCR�������˗������B
�y��U�����z
�@A�_��F2���Ƃ��x�ɂ����鈾����̔^ᇋy�шꕔ�x�Ƌ����̖������F�߂�ꂽ�B
�@B�_��F112�����1���iPCC1155�j�ŁA�x�ɑ������̔^ᇂ̌`�����F�߂��A�݂̕��啔��500�~�ʑ�̒�ᇂ��������B
�y�a���̌����z
�@5���̂ɋ��ʂ��āA�x�̍ی�����Tp�݂̂��������ꂽ�B
�@PCR������A�_��ł�2���Ƃ�Haemophilus parasuis�z���AB�_��ł�3���Ƃ��C���t���G���UA�A2����PCV2���z�����������A�ɒ[�Ȕ���s�ǂƌċz��Ǐ��Tp�ɂ�鉻�^���x���ɂ����̂Ɛf�f�����B
�y�a�����������z
�@A�_��iPCC1105�A1106�j�F�^ᇌ`�������^���x���Ɛf�f���ꂽ�B�x�̈ꕔ�ŊԎ����x�����F�߂�ꂽ�B
�@B�_��iPCC1153�A1154�A1155�j�F���^�����C�ǎx�x���y�ъԎ����x���Ɛf�f���ꂽ�B
PCC1105�iA�_��j
�@�x�F�^ᇌ`�������^���x���Ɛf�f���ꂽ�B
�@�E�^ᇂ̌`���y�шꕔ�ŊԎ����x�����F�߂�ꂽ�i�Ɖu���F�ł�PRRS�E�C���X�APCV2�A���j�i�a���X���C�h�P�S�j
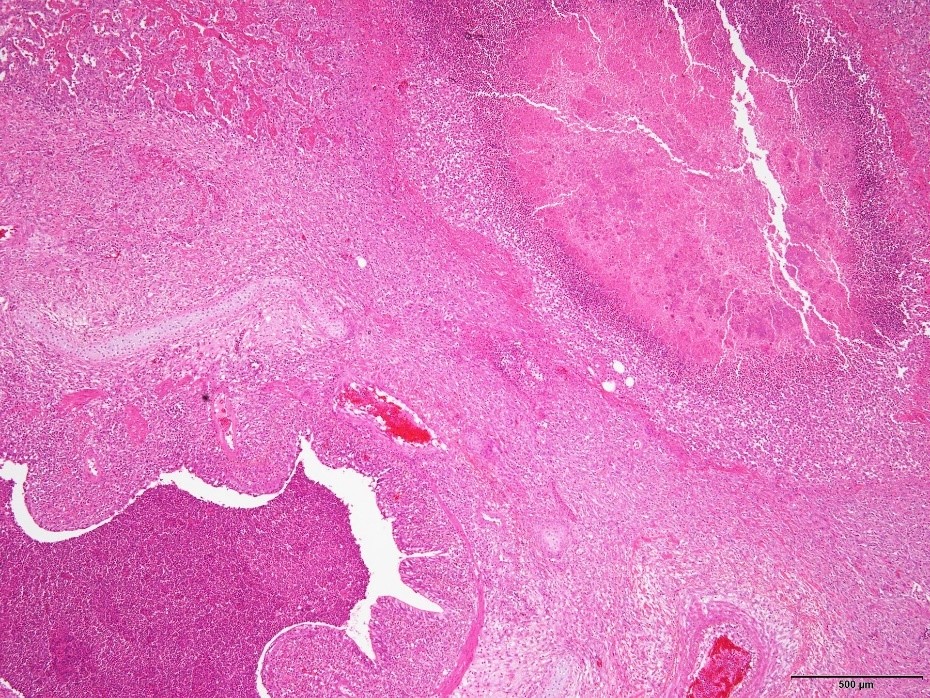
�@�E�^ᇂ̒��ɏ����ۂ̍ۉF�߂�ꂽ�B�i�a���X���C�h�P�T�j
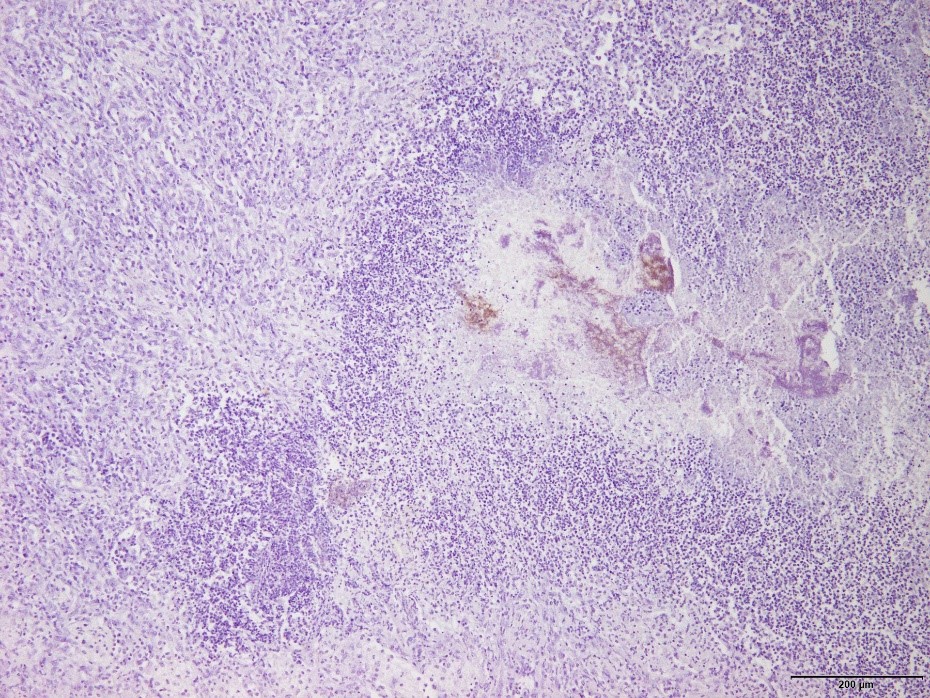
�@�E�Ɖu���F�ɂĔ^ᇓ��ɂ�����ۉ�̈ꕔ�� Actinobacillus pleuropneumoniae �iApp�j�R���z�������F�߂�ꂽ�B�i�a���X���C�h�P�U�j
�@�E�Ԏ����x�����B�i�a���X���C�h�P�V�j
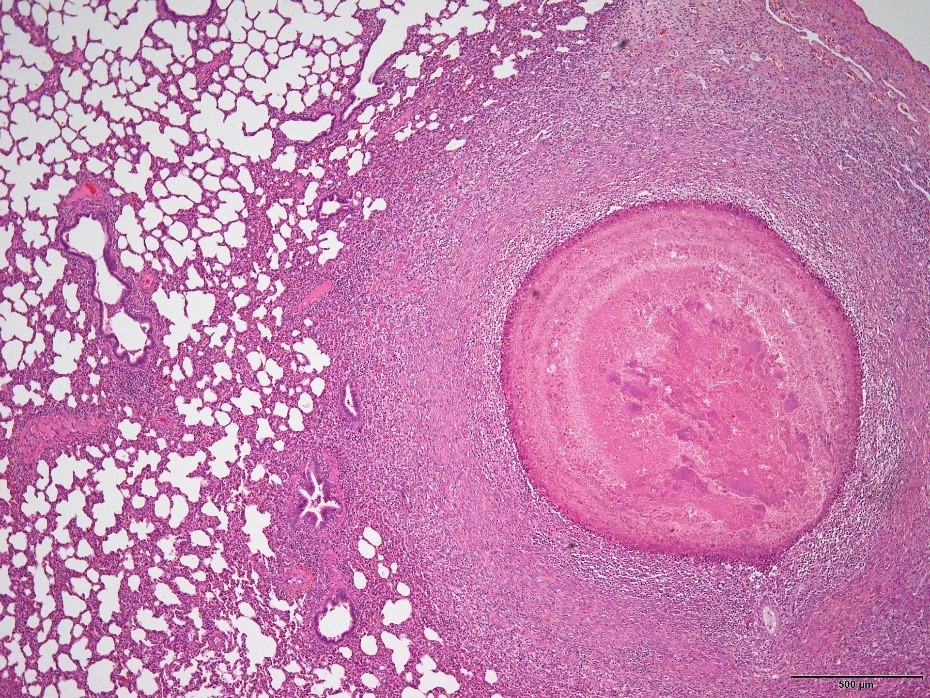
�a���X���C�h�P�S�F�^ᇂ̌`���y�шꕔ�ŊԎ����x�����F�߂�ꂽ�B
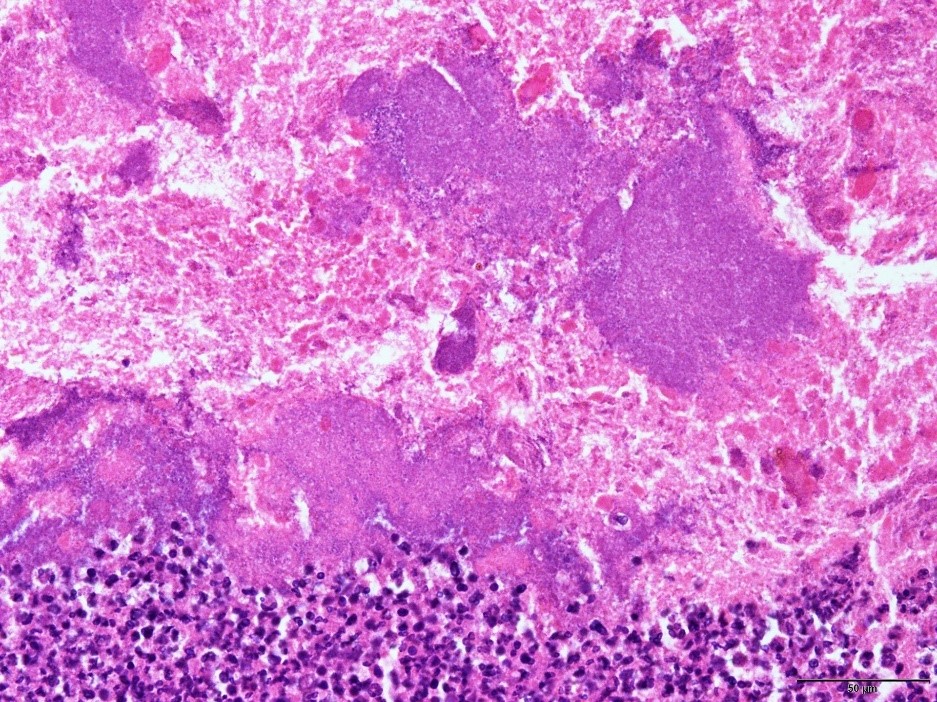
�a���X���C�h�P�T�F�^ᇂ̒��ɏ����ۂ̍ۉF�߂�ꂽ�B
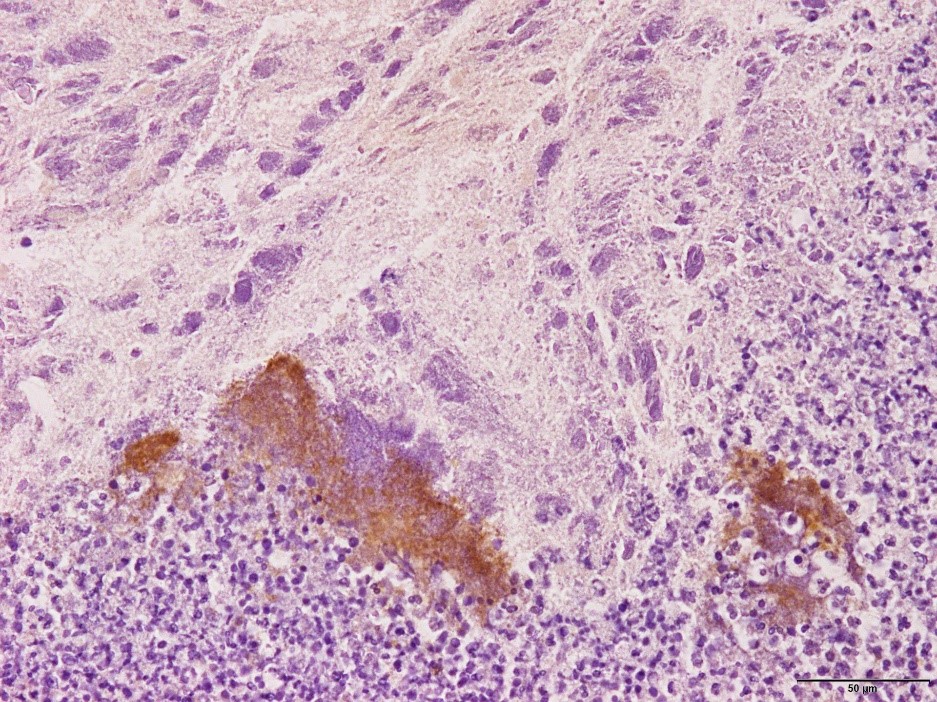
�a���X���C�h�P�U�F�Ɖu���F�ɂĔ^ᇓ��ɂ�����ۉ�̈ꕔ��App�R���z�������F�߂�ꂽ�B
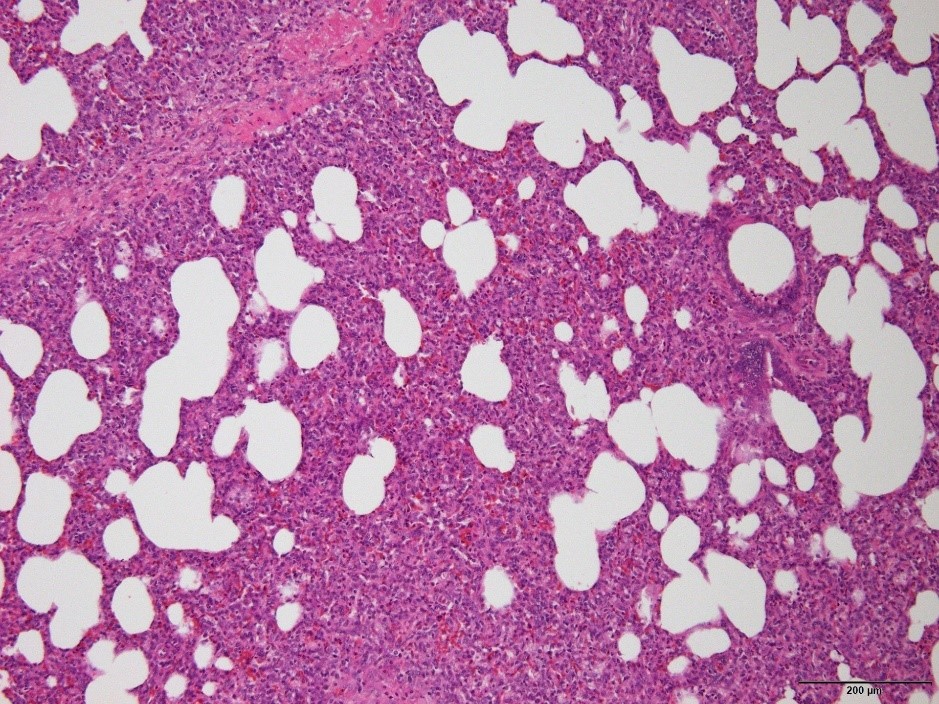
�a���X���C�h�P�V�F�Ԏ����x�����B
PCC1106�iA�_��j
�x�F�^ᇌ`�������^���x���Ɛf�f���ꂽ�B
�E�^ᇂ̌`���y�шꕔ�ŊԎ����x�����F�߂�ꂽ�B�i�a���X���C�h�P�W�j
�E�C�ǎx���ɍD�����̐Z�������^���C�ǎx�x�����F�߂�ꂽ�B�i�a���X���C�h�P�X�j
�E�Ɖu���F�ɂĔx�E�}�N���t�@�[�W����PRRS�E�C���X�R���z�����B�i�a���X���C�h�Q�O�j
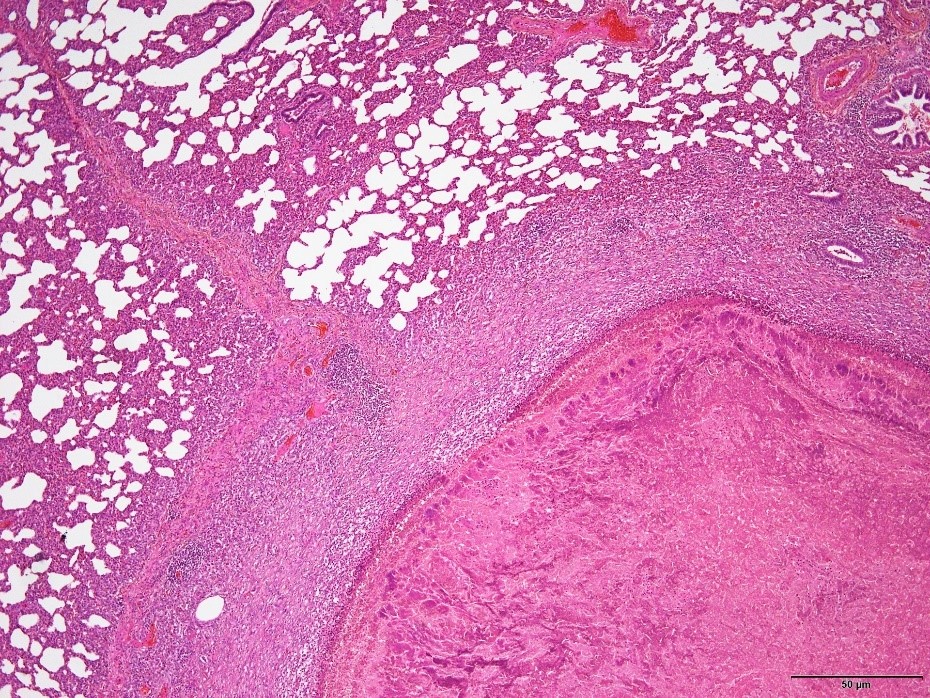
�a���X���C�h�P�W�F�^ᇂ̌`���y�шꕔ�ŊԎ����x�����F�߂�ꂽ�B
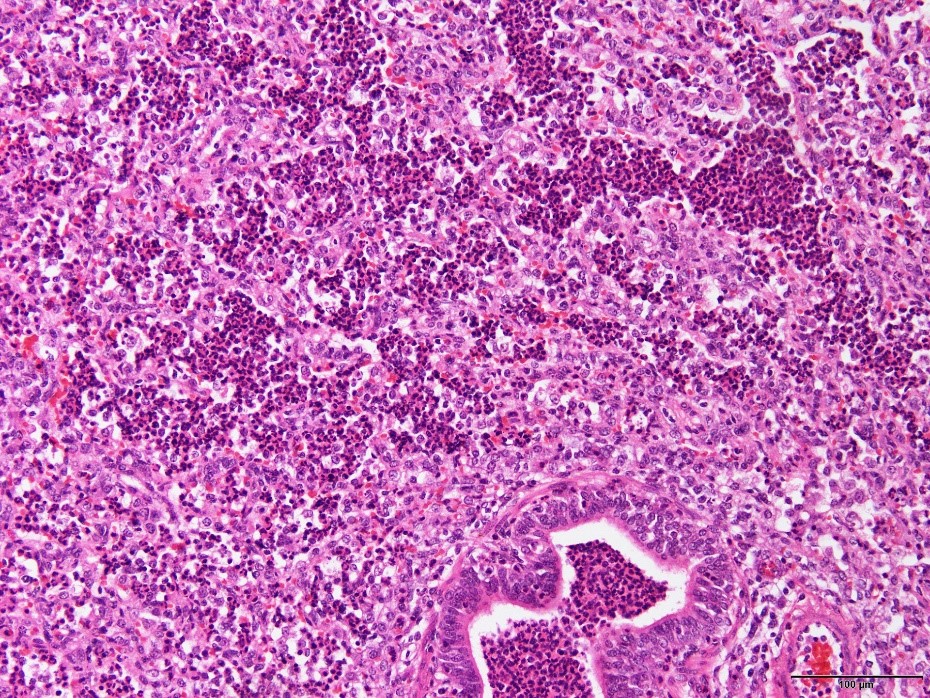
�a���X���C�h�P�X�F�C�ǎx���ɍD�����̐Z�������^���C�ǎx�x�����F�߂�ꂽ�B
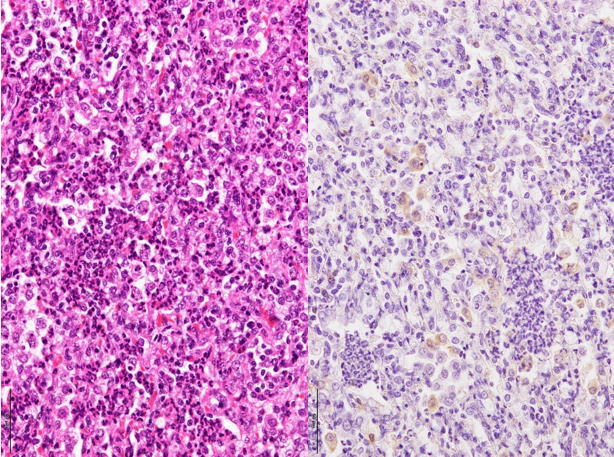
�a���X���C�h�Q�O�F�Ɖu���F�ɂĔx�E�}�N���t�@�[�W����PRRS�E�C���X�R���z�����B�i���FHE���F�A�E�F�Ɖu���F�j
PCC1153�iB�_��j
�@�x�F���^�����C�ǎx�x���A�Ԏ����x���Ɛf�f���ꂽ�B
�@�E�^ᇌ`���y�ыC�ǎx���ɏ��̉E�E���A�D�����̐Z�������^�����C�ǎx�x�����F�߂�ꂽ�B�i�a���X���C�h�Q�P�j
�@�E�Ɖu���F�ɂĔ^ᇓ��ɂ�����ۉ�̈ꕔ��App�R���z�������F�߂�ꂽ�B�i�a���X���C�h�Q�Q�j
�@�E�Ɖu���F�ɂċC�ǎx���זE���ɂ�����C���t���G���U�E�C���X�R���z�����B�i�a���X���C�h�Q�R�j
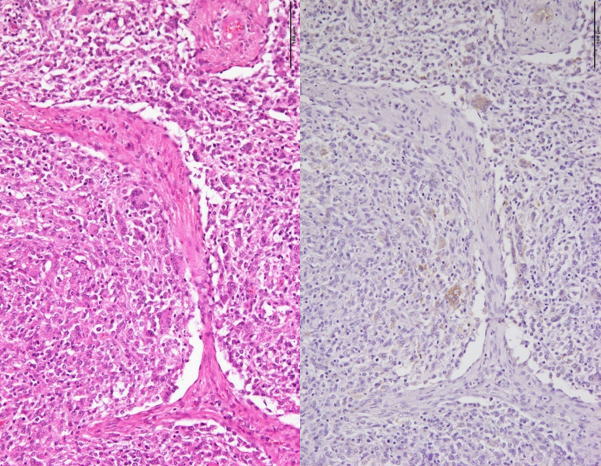
�@�E�Ɖu���F�ɂċC�ǎx���זE����ъԎ��̃}�N���t�@�[�W���ɂ�����PCV2�R���z�����B�i�a���X���C�h�Q�S�j
�@�E�Ɖu���F�ɂ�PRRS�E�C���X�R���z�����B�i�a���X���C�h�Q�T�j
�a���X���C�h�Q�P�F�^ᇌ`���y�щ��^�����C�ǎx�x�����F�߂�ꂽ�B
�a���X���C�h�Q�Q�F�Ɖu���F�ɂĔ^ᇓ��ɂ�����ۉ�̈ꕔ��App�R���z�������F�߂�ꂽ�B
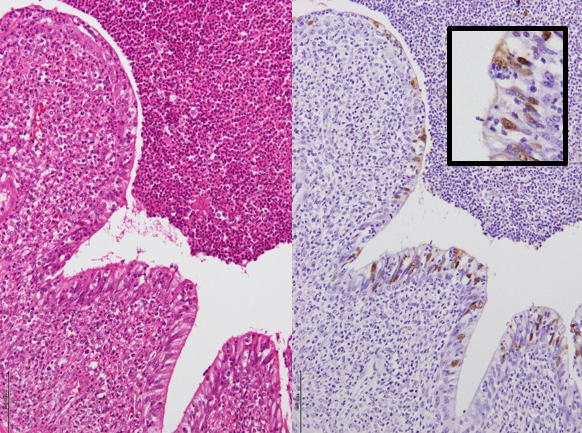
�a���X���C�h�Q�R�F�Ɖu���F�ɂċC�ǎx���זE���ɂ�����C���t���G���U�E�C���X�R���z�����B�i���FHE���F�A�E�F�Ɖu���F�j
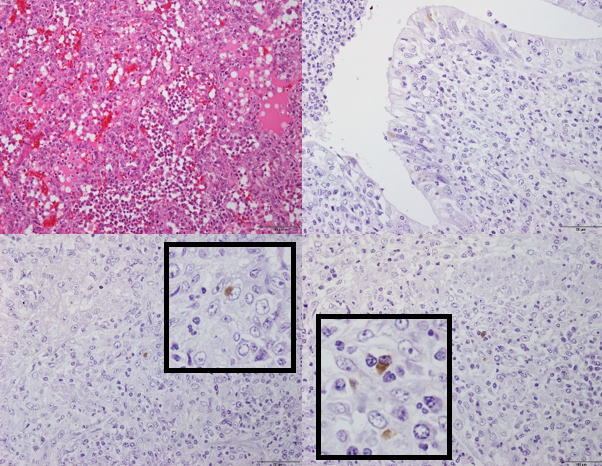
�a���X���C�h�Q�S�F�Ɖu���F�ɂċC�ǎx���זE����ъԎ��̃}�N���t�@�[�W�ɂ�����PCV2�R���z�����B�i����FHE���F�A�����E�E�F�Ɖu���F�j
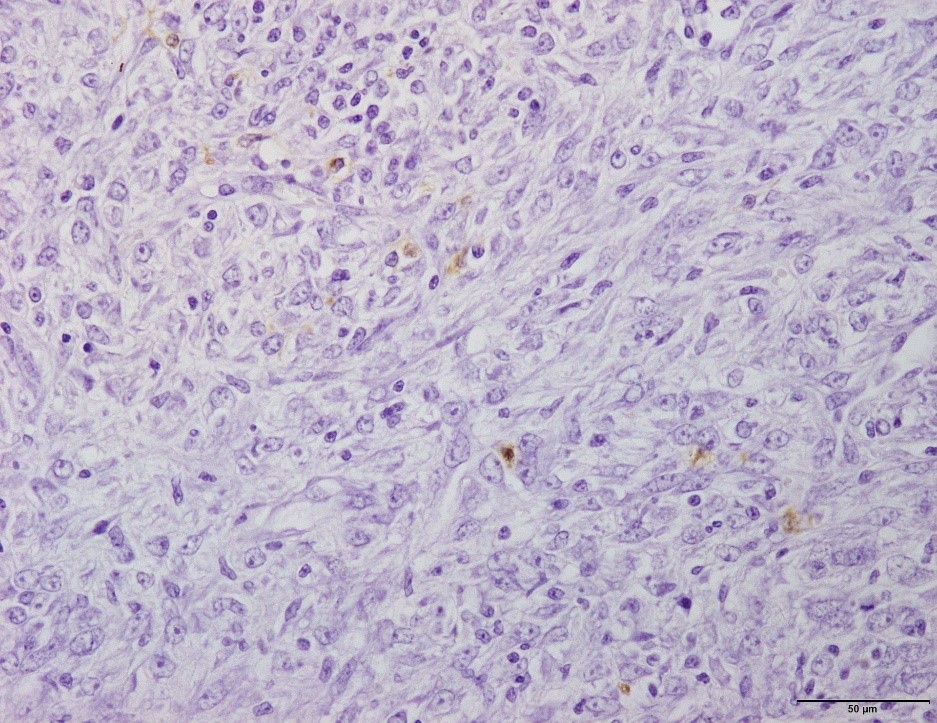
�a���X���C�h�Q�T�F�Ɖu���F�ɂ�PRRS�E�C���X�R���z�����B
PCC1154�iB�_��j
�@�x�F���^�����C�ǎx�x���A�Ԏ����x���Ɛf�f���ꂽ�B
�@�E���^�����C�ǎx�x���y�ъԎ����x�����F�߂�ꂽ�B�i�a���X���C�h�Q�U�j
�@�E�Ɖu���F�ɂ�PRRS�E�C���X�R���z�����B�i�a���X���C�h�Q�V�j
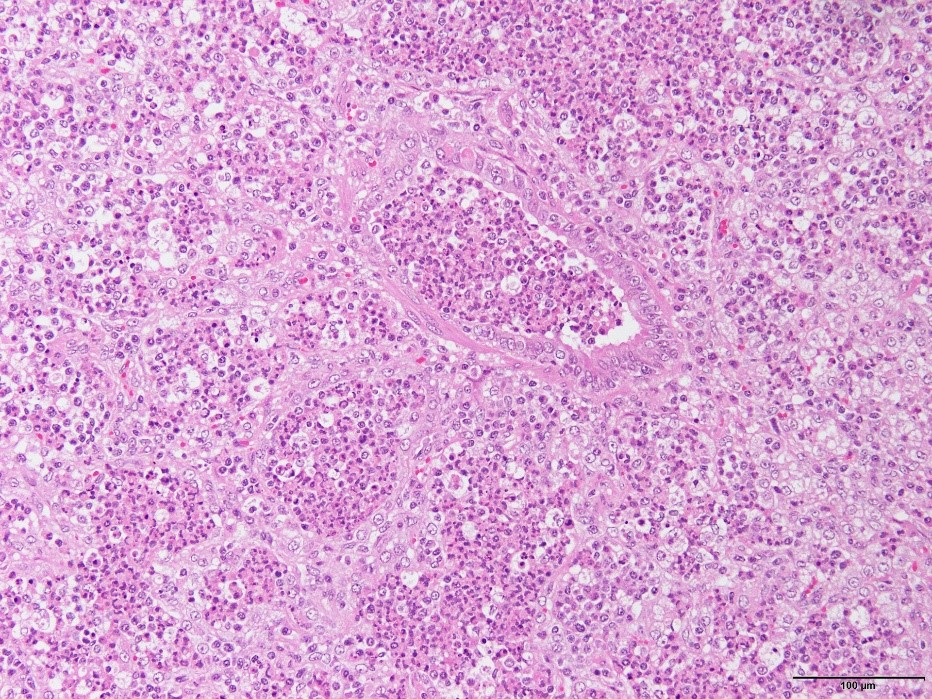
�a���X���C�h�Q�U�F���^�����C�ǎx�x���y�ъԎ����x�����F�߂�ꂽ�B
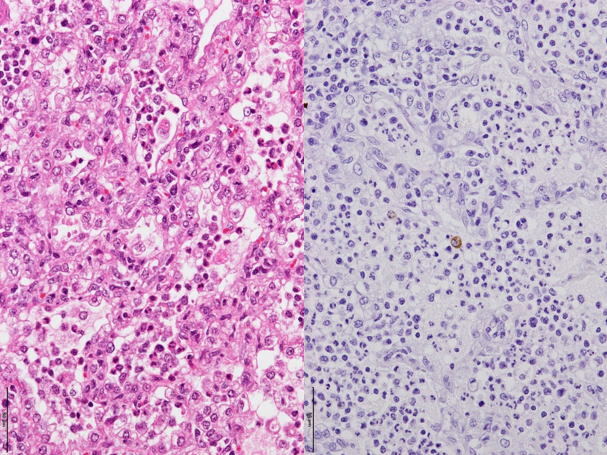
�a���X���C�h�Q�V�F�Ɖu���F�ɂ�PRRS�E�C���X�R���z�������F�߂�ꂽ�B�i���FHE���F�A�E�F�Ɖu���F�j
PCC1155�iB�_��j
�@�x�F���^�����C�ǎx�x���A�Ԏ����x���Ɛf�f���ꂽ�B
�@�E���^�����C�ǎx�x���y�ъԎ����x�����F�߂�ꂽ�B�i�a���X���C�h�Q�W�j
�@�E�Ɖu���F�ɂĔ^ᇓ��ɂ�����ۉ�̈ꕔ��App�R���z�������F�߂�ꂽ�B�i�a���X���C�h�Q�X�j
�@�E�Ɖu���F�ɂ�PRRS�E�C���X�R���z�������F�߂�ꂽ�B�i�a���X���C�h�R�O�j
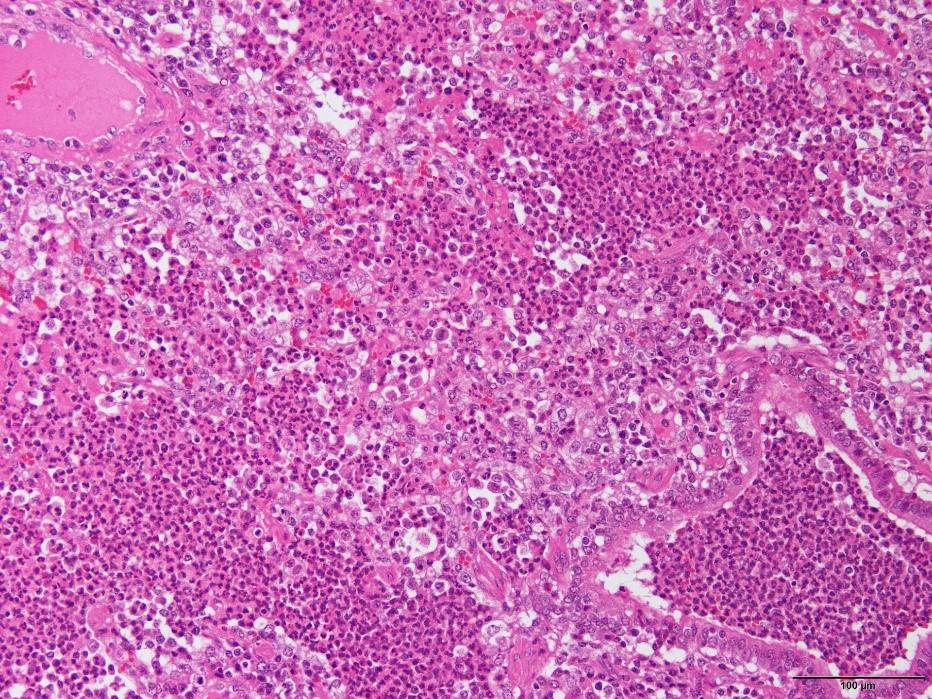
�a���X���C�h�Q�W�F���^�����C�ǎx�x���y�ъԎ����x�����F�߂�ꂽ�B
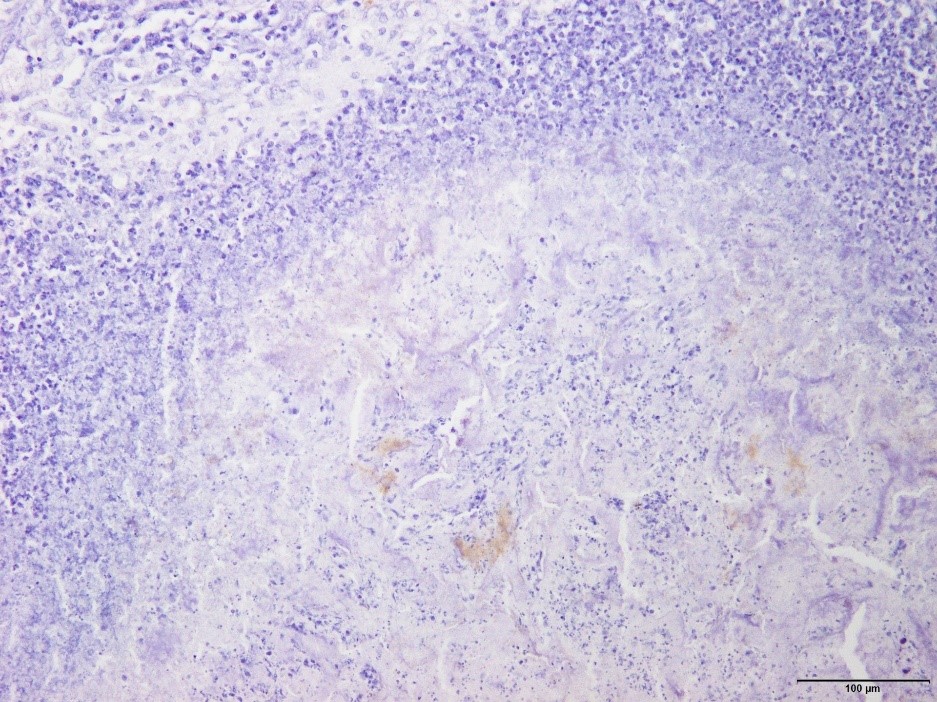
�a���X���C�h�Q�X�F�Ɖu���F�ɂĔ^ᇓ��ɂ�����ۉ�̈ꕔ��App�R���z�������F�߂�ꂽ�B
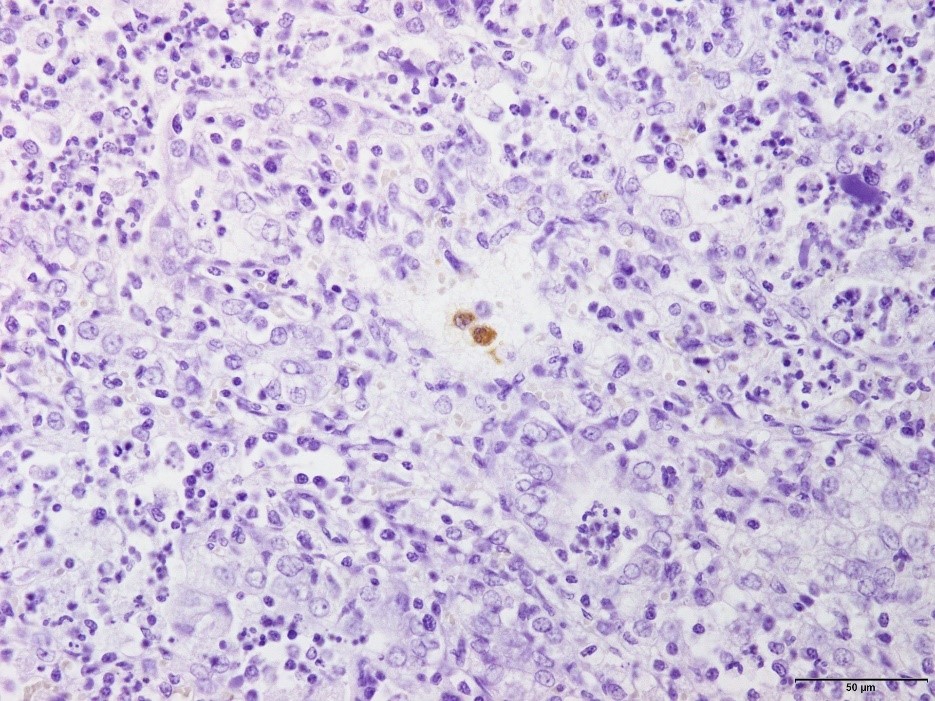
�a���X���C�h�R�O�F�Ɖu���F�ɂ�PRRS�E�C���X�R���z�����B
�Ɖu���F�ɂėz�������F�߂�ꂽ�a���̂̂܂Ƃ�
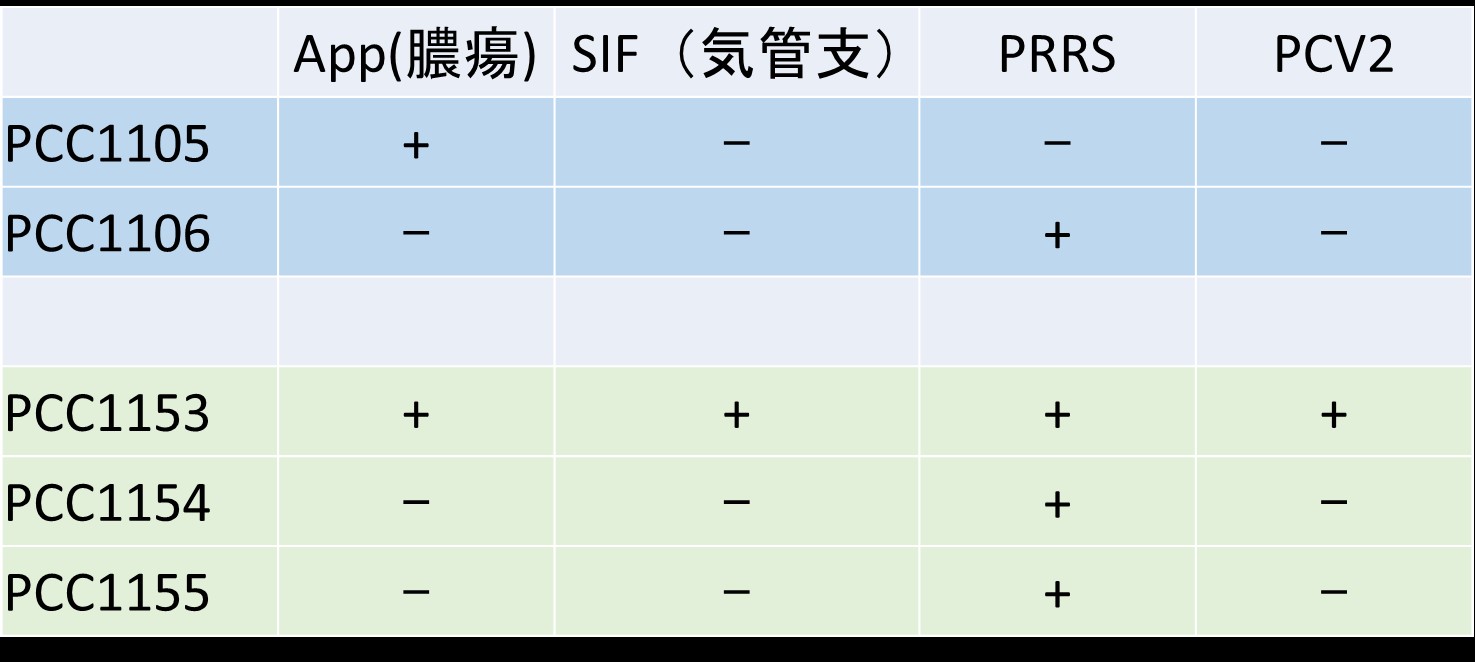
�y���ʂƑ�z
�@5���̂Ƃ��ATp����������A�a���g�D������A�_��̌��̂ʼn��^���x���AB�_��̌��̂ʼn��^�����C�ǎx�x���y�ъԎ����x���Ɛf�f���ꂽ�B���_��ɋ��ʂ��ĔF�߂�ꂽ�A�ɒ[�Ȕ���s�ǂƌċz��Ǐ��Tp���֗^�������^���x���ɂ��Ɛf�f�����B
�@Tp�͌ċz�튯���A���B�H�̔S���̏�ݍۑp�̈�ƍl�����Ă��邪�A�n����芴�������t����p�t�ɂ���ċۂ��̓��Ɋg�U���đ��l�ȑ����̕\�ɉ��^���a�ς���邱�Ƃ��m���Ă���A����̏Ǘ�ł͕a�ς���ɔx�ɏW�����Ă����B�q�őn�������̋N����\���Ƃ��āA�o�������`�сA�f���A�����A�G�⑫�̎C�菝�A���J�W���A���J�W�����l�����邪�AA�_���2���̂ł͎��J�W���A���J�W���͌���ꂸ�A���؎ɂł̊�����z�肵�A�����q���������Ƃ����`�т̃��[�h�t�ł̏��ł̓O������{���A�f���E�������ɂ����l�̏��ł̓O������{���A���̌�A���l�Ȕ���s�Ǔ͌����Ă��Ȃ��BB�_��ł͗����ɂŎ��J�W���������A�����3���̂ł������Ă���BA�_��Ɠ��l�ɁA���؎ɂł̉q����̋��������{���ł��邪�A�܂��A���̌��ʂ͌����Ă��Ȃ��B�܂��AB�_��ł�3���̒�2���̂ɂ�����PCR������PCV2�A�C���t���G���U�E�C���XA���z���ł���A�����̔���s�ǁA���̗��㏸�ւ̉e�����Ȃ����������K�v�ł���ƍl������B�Ȃ��AA�_���PCC1106�ł͖Ɖu���F��PRRS�E�C���X���z�����������APCR�����ʼnA���ł���A�܂��A���̌�̔_��̒�������ł��S��A���������̂ŁA����ٔ����ƍl����B�܂��APCC1105���̂ł͖Ɖu���F��App�z�����������A�ی����ʼnA���ł��������Ƃ���A����ٔ����̉\��������B
�y�l�@�z
�@���_��̋��ʓ_�́A���\�͕�����炵�A��ؓ�������K�͂ŁA�������ƍX�V���Ă���A���̍X�V����50���ȏ�ƍ������ƁA�ɐB�_���PRRS�A���ł��邱�ƁA�ɐB���т�PigINFO�ŏ�ʂ̗D�ǔ_��ŁA�����Y�q���A���������͂��ꂼ��AA�_���14���ȏ�E12���ȏ�AB�_��ł�13���E12������������鐬�тł���B
�@����A�C�O�̌������ʂł́A������Y���鑍�����ʂ͎Y�q���Ƒ��ւ��Ȃ��A�����̏d�Ǝq�̏����ێ�ʂ͐��̑��ւ������ƕ���Ă���B�܂��A�����ێ�ʂƂ��̌�̎��S���͕��̑��ւ�����A���ɐ����̏d���������q�ł͋������ւ��݂��邱�Ƃ�����Ă���B���̂悤�Ȃ��Ƃ���A���؎ɂł̊��A��A�q�ւ̉q�����O�ꂵ�������ŁA�ɐB���т̍������\�͕�ł́A���a�Ǘ���O�ꂵ�{�f�B�R���f�B�V������K���ɕۂ��A�����̏d�̑傫�Ȏq�Y���邱�ƁA�����ē��ɏ����Ȏq�ɏ������\���ɐێ悳����Ǘ����A����̂悤�ȏǗ�̔����h�~�◣����̐��т̍œK���ɂƂ��ďd�v�ł͂Ȃ����낤���B
�@�܂��A����̏Ǘ�ł͈ꕔ�̌��̂ŖƉu���F��PCR������ی����̌��ʂ���v���Ȃ����̂����������A���m�Ȑf�f�ɂ͕a���g�D�w�I�����A�Ɖu���F�APCR�����A�ی����̌��ʂƂƂ��ɔ_�ꗚ����Տ��Ǐ�E�ώ@�Ȃǂ��������đ����I�Ɍ������邱�Ƃ��d�v�ł���B
